
行业资讯
company
美国FDA 首仿批准清单更新
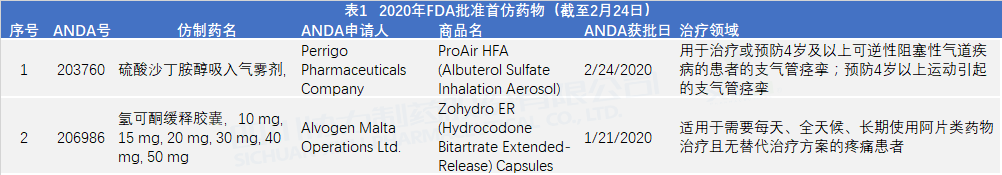
美国 FDA 于2 月24 日更新了其首仿药批准清单,这是其今年第一次更新,到 2月24 日为止,FDA 仿制药办公室(OGD)共批准了 2 个首仿药。
此前FDA还于2月14日更新了其首仿药批准清单,到 2月14 日为止,FDA 仿制药办公室(OGD)在2019年共批准了 107 个首仿药。
FDA 指出,“首仿药”是 FDA 首次批准允许生产商在美国销售的仿制药产品。FDA 认为首仿药对公共卫生极为重要,会优先审评这些申请。
同时对本文所提首仿产品作出解释:
(1)有资格获得 180 天专营权,或者没有阻碍专利或专营权的首个立卷的 ANDA;
(2)产品先前没有已获批 ANDA。
该清单更新频率为每季度一次,我们也将定期于本站更新。

参考文献:
[1] First Generic Drug Approvals. FDA.
[2] 2019 First Generic Drug Approvals


